Дисплазия тазобедренного сустава у собак
Диагностика и лечение.
Материалы докторской диссертации Ягникова С.А.
Оперативное лечение дисплазии тазобедренного сустава у собак
(обоснование, методы, результаты)
Диссертация на соискание ученой степени доктора ветеринарных наук.
Санкт-Петербург – 2005 г.
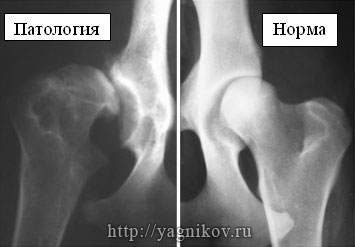
«Дисплазия» происходит от греческих слов (dys – что означает отклонение от нормы и plasia – развитие, формирование). Dysplasia– нарушение развития.
Поначалу дисплазию ТБС определяли как «врожденный подвывих» или «врожденное смещение» ТБС. В 1954 г. Schnelle предложил отменить термин “дисплазия”, заменив его селективным понятием “дисплазия ТБС”, т.к. заболевание отображает проблему только ТБС.
Наиболее часто в литературе употребляются следующие определения: «Дисплазия ТБС — это анатомический дефект недоразвития суставной впадины, который таит в себе потенциальную опасность нарушения опорно-двигательной функции тазовых конечностей». Это означает, что не каждое животное с дисплазией ТБС будет иметь клинические симптомы.
«Дисплазия ТБС — наследственно обусловленное, неправильное формирование ТБС, при котором вертлужная впадина и головка бедренной кости не соответствуют друг другу по форме».
Неправильное формирование ТБС выражается в аномальном строении головки бедренной кости или суставной впадины, или же их обеих.
В последние годы, установив влияние факторов окружающей среды на развитие дисплазии ТБС, дисплазию описывают как заболевание, обусловленное генетически и факторами окружающей среды и проявляющуюся в виде нарушения подвижности в ТБС и изменением формы суставной впадины и головки бедренной кости.
На сегодняшний день понятие дисплазия ТБС рассматривается как общее понятие, к которому относят практически все «болезни» и «отклонения от формы» в ТБС, включая увеличение шеечно-диафизарного угла (Coxa valga), антеторсию проксимального сегмента бедра и патологии суставной впадины, обусловленные люмбализацией и сакрализацией позвоночного столба.
На базе клиники проводится диагностика и лечение дисплазии тазобедренных суставов у собак в период роста и после завершения формирования скелета.
При наличии соответствующей клинической симптоматики: хромота на тазовые конечности; быстрая утомляемость; атрофия мышц; неспособность совершать прыжки; если владелец с животным останавливаются, животные быстро садится; подвывих головки бедра при ротации и др.
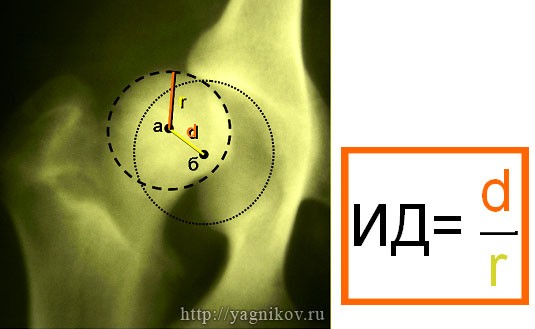
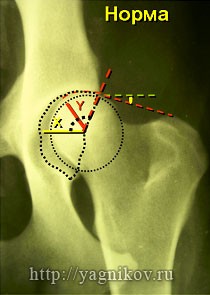
Для постановки окончательного диагноза «дисплазия тазобедренных суставов» животному на базе нашей клиники выполнят стресс рентгенограмму по методу Fluckiger.
После выполнения стресс рентгенограммы определяют индекс дистракции (ИD), который равен отношению величины d к величине r.
ИД<0,3 вероятность развития дисплазии минимальна.
ИД>0,5 большая вероятность развития дисплазии ТБС !
Вторым этапом выполняют рентгенограммы по методу DAR, для оценки дорсального края суставной впадины, величины подвывиха головки бедра и определения в цифровом исчислении угла DAR.
В норме угол DAR должен составлять 165-180?. При уменьшении угла DAR менее 165?, можно ставить диагноз – дисплазия тазобедренных суставов.
Постановка животному диагноза дисплазия ТБС позволяет врачу рекомендовать реконструктивно-восстановительные операции – тройную остеотомию таза, определить прогноз на восстановление тазовых конечностей, предъявить законные претензии к заводчикам.
Полную информацию о технике выполнения рентгенограмм и интерпретации полученных результатов можно получить по телефонам клиники.
У собак старше 12 месяцев диагноз «дисплазия тазобедренных суставов» ставят на основании рентгенографического исследования выполненного под общей анестезий, в двух стандартных укладках.
Параметры дисплазии ТБС:
- Угол Норберга ? 105? — 0
- Индекс внедрения ? 1,0 — 0
- Тангенциальный угол — 0
- Замыкательна пластина — 0
- Форма головки и арх. бедра — 0
- Экзостозы на шейке — 0
- Сумма баллов — 0
Заключение: отсутствие дисплазии ТБС.
Параметры дисплазии ТБС:
- Угол Норберга < 80? 5
- Индекс внедрения < 0,5 5
- Тангенциальный угол 5
- Замыкательна пластина — 3
- Форма головки и арх. бедра — 4
- Экзостозы на шейке — 5
- Сумма баллов -27
Заключение: тяжелая степень дисплазии.
Российский университет дружбы народов
Кафедра ветеринарной патологии
С.А. ЯГНИКОВ
ЛЕЧЕНИЕ ДИСПЛАЗИИ ТАЗОБЕДРЕННОГО СУСТАВА У СОБАК
(методические рекомендации к лекционному курсу по ветеринарной хирургии)
Москва 2006 УДК 6196617.3.57
Методические рекомендации подготовлены на кафедре ветеринарной патологии аграрного факультета РУДН. Одобрены ученым советом аграрного факультета Российского университета дружбы народов (протокол № 4).
Ягников С.А доктор ветеринарных наук.
Лечение дисплазии тазобедренного сустава у собак.
Москва, РУДН, 2005, 37 с, 2 табл.
В методических рекомендациях дано современное понятие дисплазии тазобедренных суставов у собак, описаны клинические симптомы заболевания. Даны общие рекомендации для снижения болевого симптома у данной группы животных и показана концепция медикаментозного лечения вторичного остеоартроза развивающегося на фоне дисплазии тазобедренного сустава у собак.
Описаны современные методы оперативного лечения дисплазии тазобедренного сустава, показания к данным методам, техника операции, отдаленные результаты лечения.
Методические рекомендации рекомендованы для студентов ветеринарного отделения и ветеринарных врачей, проходящих обучение по программе, постдипломного образования.
Рецензент – доктор ветеринарных наук, профессор Порфирьев И.А.
© С.А. Ягников
Список сокращений и обозначений
?АТ (угол антеторсии) – угол поворота головки бедренной кости краниально по отношению к диафизу бедрееной кости.
ГАГ – глюкозаминогликаны.
ГЭП ЦИТО – государственное экспериментальное предприятие Центрального института травматологии и ортопедии им. Н.Н. Приорова.
Дисплазия – нарушение развития.
DCP — динамическая, компрессирующая пластина.
LC DCP — динамическая, компрессирующая пластина с ограниченным контактом.
ЖКТ – желудочно-кишечный тракт.
КГ – кортикостероидные гормоны.
МО (межвертельная остеотомия) — реконструктивно-восстановительная операция, которая включает в себя клиновидную остотомию бедра в межвертельной области с последующей фиксацией крюкообразной, динамичесакой, компрессирующей пластиной.
НЖК — незаменимые жирные кислоты.
НПВП – нестероидные противовоспалительные препараты.
ОА — остеоартроз.
ПИН (пектинмиоэктомия, илиопсоастенотомия и нейротомия) – паллиативная операция, включающая миоэктомию m. pectineus, тенотомию m. iliopsoas и пересечение (разрушение) нервов и нервных окончаний, иннервирующих капсулу тазобедренного сустава.
РА (резекционная артропаластика) – остеотомия головки и шейки бедренной кости с интерпозицией между бедренной костью и суставной впадиной аутотканей.
ХС – хондроэтинсульфат.
ТОТ (тройная остеотомия таза) – реконструктивно-восстановительная операция, которая включает в себя сегментарную остеотомию лонной кости, остеотомию седалищной и подвздошной костей с последующей ротацией остотомированного сегмента таза латерально с последущей фиксацией тела подвздошной кости пластиной и винтами.
ТБС – тазобедренный сустав.
ТЭТС (тотальное эндопротезирование тазобедренного сустава) — замещение тазобедренного сустава искусственным шарниром (протезом).
?ШДУ (шеечно-диафизарный угол) — угол, образуемый осью шейки бедренной кости и осью диафизарного сегмента этой кости.
ЭА – эпидуральная анестезия.
Определение заболевания «дисплазия тазобедренных суставов»
«Дисплазия» происходит от греческих слов (dys – что означает отклонение от нормы и plasia – развитие, формирование). Dysplasia – нарушение развития.
Поначалу дисплазию ТБС определяли как «врожденный подвывих» или «врожденное смещение» ТБС. В 1954 г. Schnelle предложил отменить термин “дисплазия”, заменив его селективным понятием “дисплазия ТБС”, т.к. заболевание отображает проблему только ТБС.
Наиболее часто в литературе употребляются следующие определения: «Дисплазия ТБС — это анатомический дефект недоразвития суставной впадины, который таит в себе потенциальную опасность нарушения опорно-двигательной функции тазовых конечностей» (209). Это означает, что не каждое животное с дисплазией ТБС будет иметь клинические симптомы.
«Дисплазия ТБС — наследственно обусловленное, неправильное формирование ТБС, при котором вертлужная впадина и головка бедренной кости не соответствуют друг другу по форме». Неправильное формирование ТБС выражается в аномальном строении головки бедренной кости или суставной впадины, или же их обеих.
В последние годы, установив влияние факторов окружающей среды на развитие дисплазии ТБС, дисплазию описывают как заболевание, обусловленное генетически и факторами окружающей среды и проявляющуюся в виде нарушения подвижности в ТБС и изменением формы суставной впадины и головки бедренной кости.
На сегодняшний день понятие дисплазия ТБС рассматривается как общее понятие, к которому относят практически все «болезни» и «отклонения от формы» в ТБС, включая увеличение шеечно-диафизарного угла (Coxa valga), антеторсию проксимального сегмента бедра и патологии суставной впадины, обусловленные люмбализацией и сакрализацией позвоночного столба.
1. Консервативное лечение дисплазии ТБС
Дисплазия ТБС у собак считается неизлечимым заболеванием. Все методы консервативного и оперативного лечения направлены на снятие или уменьшение болевого симптома и замедление прогрессирования вторичного остеоартроза. Выбор тактики лечения зависит от проявления клинических симптомов и рентгенологических параметров дисплазии, возраста и массы тела животного, степени атрофии мышечной массы, назначения животного и наличия у пациента сопутствующих заболеваний.
1.1. Общие рекомендации при дисплазии тазобедренных суставов
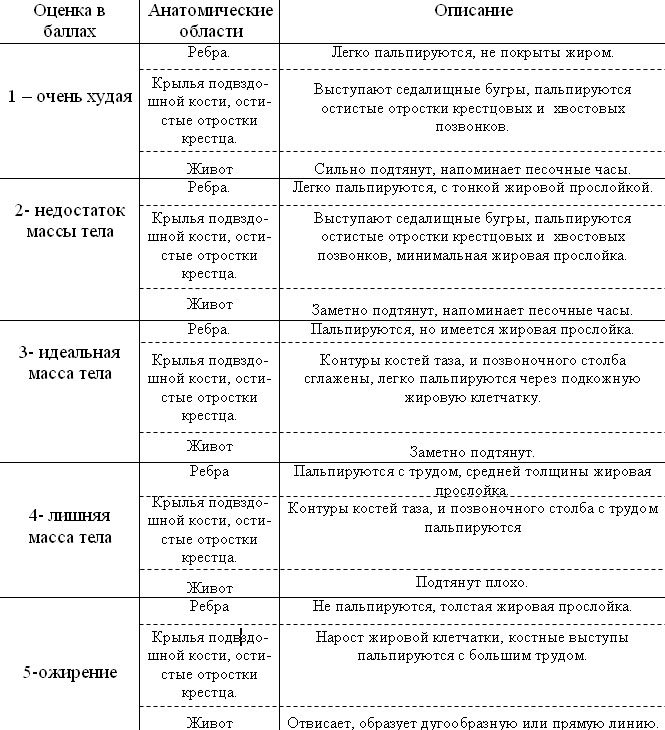
Снижение массы тела. Избыточный вес приводит к смещению центра тяжести каудально, что увеличивает нагрузку на тазовые конечности и способствует прогрессированию вторичного остеоартроза в ТБС. Контролировать массу тела животного можно на основании следующих признаков: ребра у животного легко определяются при пальпации, а у короткошерстных собак заметны при движении. При хронических болях, обусловленных вторичным остеоартрозом, только при снижении массы тела может быть получено явное клиническое улучшение. После снижения массы тела многие собаки не нуждаются в ежедневной противовоспалительной терапии.
Таблица 1. Оценка кондиции тела у собак
Ограничение движений. Собаки в период роста с избыточной нестабильностью суставов и взрослые животные с развившейся дисплазией ТБС должны избегать длительных нагрузок, так как это ведет к развитию и прогрессированию диспластического остеоартроза. У животных, страдающих дисплазией ТБС, после прогулки не должна отмечаться слабость и хромота тазовых конечностей. Если после прогулки у животного проявляется нарушение двигательной функции тазовых конечностей в виде хромоты или слабости, то нагрузка является чрезмерной и должна быть снижена.
У собак с дисплазией ТБС, которых выгуливали на газонах, обострение диспластического коксартроза наблюдали гораздо реже, чем у собак, выгуливаемых на асфальте. Животным с дисплазией ТБС рекомендуется плавание, так как в воде совершаются движения с минимальной нагрузкой на суставные поверхности и достаточно большой нагрузкой на переартикулярные мышцы, что способствует их укреплению (выделено мной).
Владельцы должны избегать передвижения животного по гладкому и скользкому полу, т.к. расползание тазовых конечностей может привести к усилению повреждений в суставе.
Холод и влажность. Холодная и влажная погода часто приводит к обострению диспластического остеоартроза, усилению хромоты, ночным болям. Собаки, страдающие дисплазией ТБС, должны находиться в теплом и сухом помещении.
2. Медикаментозное лечение дисплазии ТБС у собак
2.1. Нестероидные противовоспалительные препараты (НПВП).
НПВП являются основными препаратами при лечении ОА. Действие данной группы препаратов на течение ОА только симптоматическое (купирование болевого симптома), т.е. дегенеративные изменения в суставе невозможно ни устранить, ни остановить 40,54.
Устранение болей как важного защитного механизма приводит к прогрессированию ОА в суставах больных животных 41,75. Поэтому каждый медикаментозный препарат, обладающий противовоспалительным действием и анальгезией, следует принимать только при строгом показании и ограничении движений.
При лечении ОА НПВП и кортикостероидные гормоны (КГ) оценивают по следующим основным критериям: эффективность в снижении болевого симптома (хромоты); влияние на суставной хрящ; частота возникновения побочных эффектов.
Нестероидные противовоспалительные препараты, разрешенные для использования в ветеринарии в дозах, не превышающих клинические, не оказывают отрицательного влияния на метаболизм хрящевой ткани при ОА (таблица 2).
Наиболее частым побочным действием НПВП является НПВП — гастропатия, которая проявляется диареей и/или рвотой, иногда с примесью крови (мелена, гематомезис), вследствие развития геморрагий, эрозий и язв верхних отделов желудочно-кишечного тракта (ЖКТ) 2,13,44, 67,76.
Для профилактики НПВП-гастропатий животным назначают Н2 – блокаторы (зантак (ранитидин) 2 мг/кг массы, каждые 8 часов, per os; фамотидин 0,5 мг/кг массы, каждые 12-24 часа, в/м, п/к, per os; циметидин 2-5 мг/кг массы, каждые 12 часов, per os). Препараты данной группы применяют до окончания курса НПВП терапии 43.
Кроме того, НПВП обладают нефротоксическим и гепатотоксическим действием, поэтому назначению препаратов данной группы должны предшествовать клинический и биохимический анализы крови и общий анализ мочи. Препараты могут быть назначены только при отсутствии у пациента острых и хронических заболеваний печени и почек 8,50.
Использование большинства медицинских препаратов данной группы, даже обладающих селективным действием на блокирование ЦОГ–2, не гарантирует их эффективного противовоспалительного действия у собак и сопровождается большим процентом осложнений со стороны ЖКТ. Различные способы введения препаратов данной группы (инъекционные, per os, ректально в виде свечей) не снижают процент осложнений со стороны ЖКТ, так как при любой форме введения НПВП всасываются в кровь и оказывают системное действие на слизистую ЖКТ 9.
Курс лечения ОА НПВП может продолжаться от 5 до 28 и более дней. Врач должен стремиться к поиску минимально эффективной дозы препарата и минимально достаточной кратности применения препарата (каждый день, через день, один раз в два-три дня) для снятия болевого симптома при ОА 32,44,75.
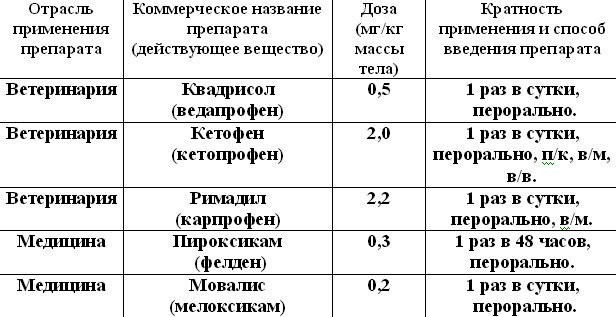
Оценивая эффективность в снижении болевого симптома и частоту возникновения побочных эффектов, из НПВП, представленных на отечественном рынке для лечения ОА собак, рациональное соотношение эффективности снижения болевого симптома к частоте побочных явлений имеют следующие препараты (таблица 2):
Таблица 2. Дозы, кратность применения и способ введения НПВП, разрешенных в ветеринарной медицине.
В последнее время НПВП широко применяются в послеоперационном периоде для снятия болевого симптома и уменьшения послеоперационного отека и воспаления. НПВП назначают в указанных дозах, но не более 2-3 суток. При более длительном курсе лечения отмечают «расхождение швов», что приводит к заживлению раны вторичным натяжением. Это обусловлено уменьшением количества фибробластов, синтезирующих коллаген и протеогликан, необходимых для сращения тканей по первичному натяжению 36.
2.2. Кортикостероидные гормоны
Кортикостероидные гормоны при диспластическом ОА являются препаратами резерва и используются при неэффективности и/или наличии осложнений после применения НПВП 18,25,28,37. КГ применяют системно или местно, посредством внутрисуставной инъекции. Внутрисуставное введение стероидов всегда критиковалось в связи с наличием большого процента инфекционных осложнений 70. Мнения разных авторов относительно влияния стероидов на суставную поверхность хряща противоречивы. Они более пессимистичны при оценке действия на суставной хрящ грызунов и более оптимистичны при анализе воздействия на суставы собак и обезьян 4,5, 13,32,33,34,59,62,72.
Оценивая результаты введения КГ в страдающий сустав, на основании данных литературы можно сделать заключение, что внутрисуставные инъекции КГ уменьшают эрозию суставного хряща, замедляют продукцию остеофитов, ингибируют активность стромелизина и пролиферацию хондроцитов. Это подтверждает мысль о том, что кортикостероиды могут замедлить прогрессирование ОА. Однако в источниках литературы не указана длительность терапии КГ, и все работы проводились на ранней стадии ОА. К тому же авторы работ указывают, что весьма сложно подобрать
дозу КГ, которая подавляла бы катаболизм в хрящевой ткани сустава и при этом не подавляла регенерацию хрящевой ткани 41,52.
Наиболее эффективным препаратом, имеющим пролонгированное действие, является дипроспан (препарат солей бетаметазона), триамцинолон и кеналог в дозе до 5 мг на инъекцию, разведенные в 1-2 мл 2% раствора лидокаина 11. Препарат вводят с интервалами 14-40 суток. Место для введения готовят как операционное поле: выстригают шерсть в месте введения иглы в полость сустава, и обрабатывают кожу раствором Лавасепт, или 0,5% спиртовым раствором хлоргексидина. После введения иглы в полость сустава сначала аспирируют синовиальную жидкость, а затем подсоединяют к игле шприц с препаратом и вводят его.
У мелких пород собак и кошек артроцентез (введение иглы в полость сустава) и внутрисуставное введение кортикостероидных гормонов затруднительно. Поэтому мелким животным мы рекомендуем выполнять подкожную инъекцию пролонгированных кортикостероидных гормонов (дексафорт, один раз в 10-14 суток, подкожно, 2-3 инъекции).
Наиболее типичное осложнение – полидипсия (повышенная жажда) и полиурия (увеличение объема мочи и частоты мочеиспускания) у животного после введения препарата в течение 5-12 суток. Полидипсия и полиурия постепенно снижаются и прекращаются. При этом животное нельзя ограничивать в воде.
Противопоказанием для внутрисуставной инъекции КГ являются инфекционный артрит, запланированная операции на суставе, гипергликемия.
2.3. Медленно действующие препараты
Известно много кандидатов на роль препаратов, изменяющих структуру хрящевой ткани при ОА. Но по данным литературы, только Cosequin в дозе 1-4 капсулы в сут per os; Glucoflex, Adequan в дозе 4,4 мг/кг один раз в 3-5 сут, в/м, восемь инъекций на курс и Структум («Пьер Фабр») по 500-1000 мг/сут в два приема, per os оправдали себя в произвольных, дважды слепых клинических исследованиях как препараты, положительно изменяющие течение ОА на уровне ткани и купирующие болевой симптом 15,16,28,46,55,68,72.
Механизм действия препаратов данной группы при лечении ОА до конца не изучен. На сегодняшний день он складывается из нескольких составляющих: ингибирование ферментов воспаления, в особенности металлопротеиназы и стромелизина, удаление кислородных радикалов и стимулирование синтеза гиалурона. Глюкозаминогликаны (ГАГ) обладают анаболическим эффектом для хондроцитов, а также тормозят катаболические процессы в хряще и стимулируют синтез гиалурона. Гиалурон повышает вязкость синовиальной жидкости и «покрывает» суставные поверхности, создавая барьер цитокинам и металлопротеиназе, вызывающим повреждение матрицы хряща 52,57,62,70.
Сегодня на ветеринарном рынке появилось много препаратов на основе глюкозаминогликана для лечения ОА. Поскольку очищенный хондроитинсульфат (ХС) дорого стоит, то предлагается считать альтернативные источники эффективными просто потому, что они содержат
ГАГ. Пищевые добавки и препараты, рекомендуемые как альтернатива ХС И ГАГ содержат порошок хряща акулы, цыплят или крупного рогатого скота, морской огурец, двустворчатую раковину Perna, желатин и др. Однако нет клинических исследований, которые бы доказали эффективность пищевых добавок в лечении ОА, и целесообразность их применения основывается только на теоретических домыслах авторов 16.
2.4. Анаболические стероиды
При ОА крупных суставов использование препаратов, увеличивающих мышечную массу, может привести к функциональному улучшению 56,59,71. Это происходит за счет увеличения стабильности сустава и обогащения суставного хряща мукополисахаридами 71. Анаболические cтероиды рекомендуют применять у собак после завершения роста костей, так как препараты данной группы способствуют «закрытию» эпифизарных зон роста и препятствуют продолжению роста костей 50,71. Применение анаболических препаратов рекомендовано сочетать с проведением дозированных тренировок 56,59,71.
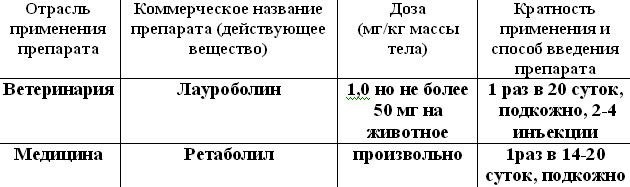
К сожалению, препараты данной группы запрещены в ветеринарной медицине. Но мы приведем дозы и кратность применения препартов данной группы у мелких домашних животных.
Таблица 3. Дозы, кратность применения и способ введения анаболических стероидов разрешенных в ветеринарной медицине.
2.5. Антиоксиданты
К антиоксидантам относят витамины С, Е, микроэлемент – селен. Механизм действия антиоксидантов сводится к снижению уровня свободных радикалов в полости сустава, которые являются промоутерами воспаления и способствуют деградации протеогликанов.
Концентрация витамина С в плазме крови у здоровых собак крупных пород составляет 7,02 мг/л. При боли, обусловленной остеоартрозом, концентрация витамина С резко падает 48. Уровень витамина С регулируется за счет его выработки в организме животного. Чтобы оказать положительное влияние на ОА, требуются высокие концентрации витамина в тканях. Доза 90 мг/кг потребовалась, чтобы получить клиническое улучшение ОА у собак, но результаты этого исследования никем не подтверждены 16,18. Патогенез уменьшения боли при ОА обусловлен решающей ролью витамина С в синтезе коллагена 65. Вероятность получения положительного эффекта при лечении ОА, используя большие дозы витамина С, граничит с большей вероятностью получить побочные эффекты со стороны ЖКТ 18,48. Эффективность других антиоксидантов в лечении ОА в ветеринарной медицине не оценивалась 16.
2.6. Препараты растительного происхождения.
Препараты растительного происхождения, предлагаемые в качестве потенциально «хрящезащитных», включают растения семейства Agavaceae. Вещества, производные от этих растений, в течение ряда лет используются для лечения недомоганий человека. Но никаких исследований в ветеринарии, документально подтверждающих или опровергающих их эффективность при лечении ОА, нет. Многие из этих растений и трав обладают неизвестным противовоспалительным действием, но не удовлетворяют критериям определения их в качестве препаратов, облегчающих симптомы или восстанавливающих суставной хрящ 23.
2.7. Незаменимые жирные кислоты (НЖК)
НЖК омега-3 блокирует фермент аггреканазу, который участвует в разрушении протеогликана – белковополисахаридного комплекса, обеспечивающего стабильность структуры коллагеновой сети суставного хряща 27. Исследования на культуре хондроцитов показали, что НЖК омега-3 снижает экспрессию циклооксигеназ и цитокинов, а также снижает активность аггреканазы. Диетические корма, содержащие НЖК, могут помочь снизить продукцию провоспалительных простагландинов в суставах, поражённых ОА, и тем самым способствовать снижению доз НПВП и уменьшить риск развития побочных осложнений. Однако в исследованиях, подтверждающих эффективность НЖК при лечении ОА, использовали большие дозы НЖК (в пределах 2-5 г в сутки), чтобы получить клинические результаты 25,77. Сомнительно, что меньшее количество НЖК, добавленных в диетический корм или пищевую добавку, может дать положительный эффект у человека и животных, страдающих ОА 25,77.
2.8. Вязкоэластичные препараты
Синовиальная жидкость в больном суставе теряет свою смазывающую функцию, а также теряет демпферную (амортизирующую) и притягивающую способность. Все эти свойства обусловлены вязкоэластичностью синовиальной жидкости. Препараты, призванные восполнить вязкоэластичность, синтезированы на основе гиалурона, и сырьем для их производства служат гребешки петухов. Повышение вязкости препаратов данной группы обусловлено наличием поперечных связей между молекулами гиалурона, которые обеспечивают высокий молекулярный вес препарата 7. Терапевтическое действие препаратов распространяется только на пораженный сустав. Оно обусловлено исключительно их реологическими свойствами и не связано с фармакологическим, иммунологическим или метаболическим воздействием. Поэтому в мире принято называть препараты Гиалган и Синвиск — устройство. По эффективности купирования болевого симптома при ОА препараты данной группы конкурируют с НПВП 3. Однако они имеют один существенный недостаток, ограничивающий их широкое применение в ветеринарной медицине – высокая стоимость. Один курс лечения ОА состоит из трех – пяти внутрисуставных инъекций по 1-2,0 мл препарата на каждую инъекцию с интервалом в одну неделю 7.
2.9. Коллаген II типа
Гиалиновый хрящ первично состоит из коллагена II типа и в меньшей мере из типов IX и XI. Беспорядочная структура коллагена II типа составляет сущность нормального функционирования гиалинового хряща. Повреждение поверхности гиалинового хряща считается побуждающим фактором и причиной прогрессирования ОА 4,43. В процессе двух исследований, проведенных на собаках с естественно протекающей болезнью суставов, идентифицированы аутоантитела, направленные против коллагена II типа. Эти факты указывают на то, что аутоиммунитет – это, как минимум, составляющая часть в прогрессировании болезней суставов у людей и животных 17,58. Потенциал коллагена в терапии болезней суставов еще неизвестен. Требуется провести ряд исследований, прежде чем коллаген может быть рекомендован для лечения болезней суставов 17,58.
2.10. Генная терапия
Подход генной терапии к лечению ОА заключается во введении генов-ингибиторов цитокинов, интерлейкина (ИЛ-1) и фактора некроза опухоли (TNF), например IL-RAP, и растворимого рецептора ЕТА, а также введение генов для тканевых ингибиторов металлопротеиназ (TIMP-1, TIMP-2) и генов для трансформирующего фактора роста (TGF-?). Эти гены, единожды активированные, будут производить большее количество ингибиторов интерлейкина-1 и фактора некроза опухоли, ингибируя повреждающее действие цитокинов. Продукция ингибиторов повышается и подавляет разрушающее действие металлопротеиназ на суставной хрящ. Ген трансформирующего фактора роста стимулирует продукцию фактора роста, который способствует регенерации и восстановлению хрящевой ткани 22,31,69.
2.11. Альтернативные формы терапии
Экстраартикулярная имплантация золотых частиц в точку акупунктуры в области тазобедренного сустава способствовала нейтрализации возникающего в суставе отрицательного электрического заряда, что приводило к уменьшению боли в течение 3-4 недель и замедлению диспластического остеоартроза 30,45,61.
2.1.2 Заключение
Медикаментозное лечение ОА должно состоять из препаратов с учетом следующих приоритетов: 1) купирование болевого симптома; 2) синовита; 3) нарушений трофики суставного хряща и субхондральной кости; 4) гипотрофии мышц. Применяя вышеизложенные группы препаратов, врач должен знать, на какое патогенетическое звено ОА он воздействует, и быть уверен в целесообразности назначения тех или иных ветеринарных или медицинских препаратов и пищевых добавок.
3. Оперативные методы лечения дисплазии тазобедренных суставов
Оперативное лечение дисплазии направлено на уменьшение болевого симптома, улучшение функции сустава и замедление развития вторичного остеоартроза. Рекомендация к той или иной операции дается лишь тогда, когда прогноз после операции будет более благоприятным, чем без неё, причем операционный риск и опасность развития осложнений после операции должны быть ниже прогнозируемого улучшения.
К оперативным методам лечения дисплазии ТБС относят:
3.1. Миоэктомия m.pectineus15
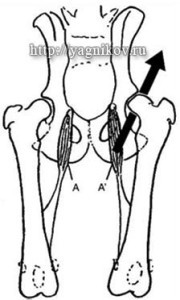 Сегодня миоэктомию гребешковой мышцы у собак в период роста не рассматривают как профилактику развития дисплазии ТБС у собак. Но клинические наблюдения показали, что иссечение этой мышцы приводит к уменьшению хромоты (боли) и способствует восстановлению двигательной функции тазовой конечности при дисплазии ТБС.
Сегодня миоэктомию гребешковой мышцы у собак в период роста не рассматривают как профилактику развития дисплазии ТБС у собак. Но клинические наблюдения показали, что иссечение этой мышцы приводит к уменьшению хромоты (боли) и способствует восстановлению двигательной функции тазовой конечности при дисплазии ТБС.
Уменьшение боли после данной операции обусловлено уменьшением подвывиха головки бедра, напряжения капсулы сустава и раздражения нервных окончаний запирательного нерва, иннервирующего дорсальную часть капсулы сустава, а также отсутствием болевого симптома, исходящего от напряженной гребешковой мышцы. Операция не влияет на развитие и прогрессирование вторичного остеоартроза, носит симптоматический характер и имеет временный успех по купированию болевого симптома. Результат операции в виде уменьшения или полного исчезновения хромоты тазовой конечности может быть от нескольких месяцев до 5-6 лет. Основными факторами, влияющими на эффективность операции, являются возраст пациента и степень диспластического коксартроза.
 Показанием к операции служат случаи неэффективного медикаментозного лечения или наличия осложнений при медикаментозной терапии диспластического остеоартроза, а также пациенты, у которых имеются противопоказания к тройной остеотомии таза, межвертельной остеотомии или эндопротезированию ТБС. Однако операция показана лишь в том случае, если целью является только уменьшение болевого симптома. Операция наиболее эффективна для купирования боли в конце фазы роста у молодых собак в возрасте от 6 до 12 мес. Другие авторы рекомендуют пектинмиоэктомию у старых собак с обострением диспластического коксартроза и тяжелой хромотой. Но есть мнение, что операция показана животным всех возрастов. Эффект от операции можно ожидать только у собак с нестабильными суставами и коксартрозом легкой степени. Преимущество заключается в том, что при отсутствии эффекта от данной операции возможно выполнение более радикальных операций.
Показанием к операции служат случаи неэффективного медикаментозного лечения или наличия осложнений при медикаментозной терапии диспластического остеоартроза, а также пациенты, у которых имеются противопоказания к тройной остеотомии таза, межвертельной остеотомии или эндопротезированию ТБС. Однако операция показана лишь в том случае, если целью является только уменьшение болевого симптома. Операция наиболее эффективна для купирования боли в конце фазы роста у молодых собак в возрасте от 6 до 12 мес. Другие авторы рекомендуют пектинмиоэктомию у старых собак с обострением диспластического коксартроза и тяжелой хромотой. Но есть мнение, что операция показана животным всех возрастов. Эффект от операции можно ожидать только у собак с нестабильными суставами и коксартрозом легкой степени. Преимущество заключается в том, что при отсутствии эффекта от данной операции возможно выполнение более радикальных операций.
Операция не способствует восстановлению нормальной походки. Только у молодых собак в возрасте 5-6 мес операция может изменить походку, приведя её к норме, но это невозможно точно предсказать.
В литературе описано несколько техник операции, но наиболее перспективной является полное иссечение гребешковой мышцы. Операцию выполняют билатерально, даже если дисплазией поражен только один ТБС. В день операции животное отпускают домой, рекомендуют ограничение движений до 10-12 суток.
3.2. Денервация капсулы сустава15
Денервация суставной капсулы ТБС является паллиативной операцией, направленной на уменьшение или снятие болевого симптома, и не влияет на развитие диспластического остеоартроза.
Показания. Операция показана собакам разного возраста, которые имеют дисплазию ТБС и клинически определяемую хромоту, обусловленную болью. Причем данная операция является самым простым способом купировать болевой симптом.
Денервация капсулы сустава приводит к уменьшению боли, возрастанию активности движений и, как следствие, к увеличению мышечной массы и стабилизации ТБС.
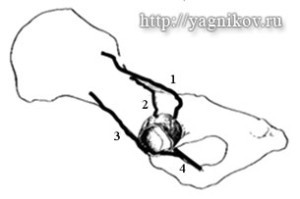 Техника операции состоит в разрушении периоста подвздошной кости полукругом на ширину 5 мм до основания капсулы сустава. При этом повреждаются ветви n.glutaeus cranialis и n.ischiadicus, иннерви-рующие краниола-теральную и краниоме-диальную части капсулы сустава. Однако для достижения полной денервации и купирования болевого симптома, обусловленного дисплазией ТБС, необходимо разрушение нервных окончаний всех четырех нервов, иннервирующих суставную капсулу (n.glutaeus cranialis, n.ischiadicus, n.femoralis и n.obturatorius), а также селективной мышечной иннервации капсулы, исходящей из m. articulares coxae, m. iliopsoas, m. gemelli и периостальных нервных волокон, максимальное скопление которых отмечено в краниолатеральной части суставной впадины. Операция проводится одномоментно – на двух суставах. В послеоперационном периоде рекомендовано ограничение движений в течение 7 сут. Повторное возникновение боли некоторые авторы связывают с восстановлением иннервации. Однако более поздние долговременные результаты опровергают данную точку зрения.
Техника операции состоит в разрушении периоста подвздошной кости полукругом на ширину 5 мм до основания капсулы сустава. При этом повреждаются ветви n.glutaeus cranialis и n.ischiadicus, иннерви-рующие краниола-теральную и краниоме-диальную части капсулы сустава. Однако для достижения полной денервации и купирования болевого симптома, обусловленного дисплазией ТБС, необходимо разрушение нервных окончаний всех четырех нервов, иннервирующих суставную капсулу (n.glutaeus cranialis, n.ischiadicus, n.femoralis и n.obturatorius), а также селективной мышечной иннервации капсулы, исходящей из m. articulares coxae, m. iliopsoas, m. gemelli и периостальных нервных волокон, максимальное скопление которых отмечено в краниолатеральной части суставной впадины. Операция проводится одномоментно – на двух суставах. В послеоперационном периоде рекомендовано ограничение движений в течение 7 сут. Повторное возникновение боли некоторые авторы связывают с восстановлением иннервации. Однако более поздние долговременные результаты опровергают данную точку зрения.
На сегодняшний день нет единства мнений по следующим вопросам: 1) в каком объеме необходимо выполнять операцию и дает ли полная денервация капсулы сустава, более продолжительный и клинически более выраженный эффект; 2) приводит ли денервация капсулы сустава к прогрессированию ОА вследствие уменьшения щажения конечности; 3) в каком возрасте целесообразно проводить данную операцию.
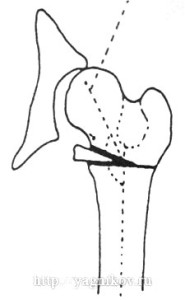
3.3. Резекционная артропластика
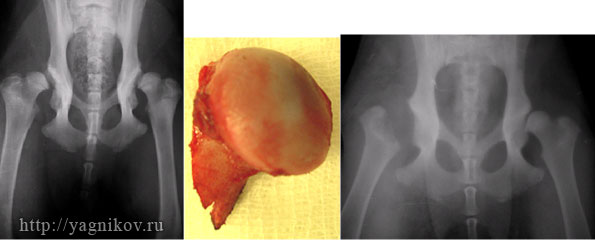
Резекцию головки и шейки бедренной кости называют также резекционная (РА) или эксцизионная артропластика, цель которой состоит в устранении болезненного контакта между головкой и суставной впадиной при диспластическом коксартрозе. После операции бедренная кость и суставная впадина не соприкасаются. Между ними развивается соединительно-тканная прослойка. Оперированная конечность несет часть массы тела собаки. Резекционная артропластика показана в тех случаях, когда реконструктивно восстановительные операции или эндопротезирование ТБС не могут быть выполнены пациенту по тем или иным причинам. Резекцию головки и шейки бедра выполняют как «спасательное мероприятие» у собак с дисплазией тяжёлой степени, сопровождающейся сильной болью. Другие авторы считают наличие у собак клинически определяемой хромоты на фоне дисплазии ТБС достаточным аргументом для выполнения РА. После РА возможно эндопротезирование ТБС, хотя перспективы на восстановление адекватной биомеханики конечности сомнительны. РА показана взрослым собакам, но может быть выполнена с успехом в любом возрасте.
Операция наиболее эффективна у мелких пород собак с массой тела до 15-22 кг. У собак массой тела более 20 кг операция не приводит к снижению боли, и большинство владельцев не отмечают улучшений функции оперированной конечности или отмечают незначительный положительный эффект. Улучшить результаты РА у крупных пород собак можно, поддерживая соответствующую форму тела (ребра должны легко пальпироваться). Последние работы показывают, что и у собак массой тела более 22 кг можно получить хорошие и отличные функциональные результаты после выполнения РА. Для увеличения эффективности операции используются модифицированные техники с транспозицией между бедренной костью и суставной впадиной мышечных лоскутов или капсулы сустава, играющих демпферную функцию. Также следует удалить сильно выраженные остеофиты на суставной впадине и выполнить остеотомию малого вертела.
Рисунок. Рентгенограммы таза собаки в первой позиции. Дисплазия обоих ТБС. Резекционной артропластики правого ТБС по W.OFF.
После РА происходит укорочение оперированной тазовой конечности и уменьшается объем движений вследствие формирования соединительно тканного подвижного сочленения на месте ТБС, что приводит к ограничению движения тазовой конечности и мышечной атрофии, неподдающейся терапии. При нагрузке прооперированная конечность устает раньше, а после непродолжительного отдыха быстро восстанавливает двигательную функцию. РА противопоказана собакам с неврологической симптоматикой.
Техника операции
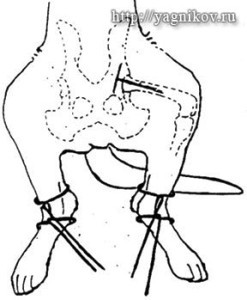
Способ по Lippincott. К тазобедренному суставу выполняли краниолатеральный доступ по Archibald. Проводили поперечную артротомию краниальной части капсулы сустава от места прикрепления к костям таза до шейки бедренной кости. Долотом, или осцилляторной пилой, выполняли остеотомию головки и шейки бедренной кости. Затем формировали мышечный лоскут из m. biceps femoris и через сформированное отверстие в каудальной части капсулы сустава проводили его в полость сустава для интерпозиции между бедренной костью и суставной впадиной. Свободный конец мышечного лоскута подшивали к краниальной части капсулы сустава и m. vastus lateralis капроном, узловыми швами.
Способ по Berzon. К тазобедренному суставу выполняли краниолатеральный доступ по Archibald. Долотом или осцилляторной пилой проводили остеотомию головки и шейки бедренной кости по линии, соединяющей trochanter major и trochanter minor. Для уменьшения боли от трения между костями и ускорения периода реабилитации между бедренной костью и костями таза помещали мышечный лоскут, сформированный из m. gluteus profundus. Просверливали два отверстия в бедренной кости в месте остеотомии шейки. Мышечный лоскут, подшивали к месту остеотомии шейки бедренной кости, проводя нити через сформированные отверстия.
Способ по Off. К тазобедренному суставу выполняли краниолатеральный доступ по Archibald. По уровню шейки выполняли артротомию ТБС. Вывихивали головку из суставной впадины и капсулы сустава. Долотом или осцилляторной пилой по линии, соединяющей trochanter major и trochanter minor, выполняли остеотомию головки и шейки бедренной кости. Для предотвращения болезненного контакта между бедренной костью и суставной впадиной интерпонировали гипертрофированную капсулу тазобедренного сустава, сшивая дорсальную и вентральную части капсулы узловыми швами.
Собственный способ (Ягников С.А.). К тазобедренному суставу выполняли краниолатеральный доступ по Archibald. Производили поперечную артротомию краниальной части капсулы сустава от места прикрепления капсулы к костям таза до шейки бедренной кости. Долотом или осцилляторной пилой выполняли остеотомию головки и шейки бедренной кости. Затем распатором отделяли проксимальную часть m. vastus lateralis от подлежащей бедренной кости на протяжении 2-5 см. Затем интерпонировали проксимальную часть m. vastus lateralis дорсокаудально в полость капсулы сустава (между костями таза и бедренной костью) и подшивали к каудальной части капсулы сустава, П-образными швами, капроном.
Послеоперационное лечение. Животное может быть отпущено домой в день операции. Для образования эластичной соединительной ткани на уровне ТБС после РА животное как можно раньше должно начать опираться на оперированную конечность. Владелец животного должен ежедневно совершать от 50 до 120 пассивных движений, совершая сгибание, разгибание, отведение и приведение тазовой конечности. При наличии боли, в первые 10-14 сут после операции, за час до процедуры показаны анальгетики. Через две недели после операции болевые ощущения должны пройти. До удаления швов необходимо ограничивать животное в движениях (прогулки на поводке или свободное движение на ограниченной территории. Через 14 сут двигательную активность можно увеличить, рекомендовать быстрый бег, плавание, ходьбу по глубокому снегу, подъем по лестнице.
В первые 10-14суток, собака опирается только на кончики фаланг пальцев, через 3 недели конечность частично нагружается, а через 4 недели должна активно использоваться. От момента операции до максимального улучшения функции конечности проходит от 2 до 5-6 месяцев. Чем сильнее выражена мышечная атрофия, тем дольше период восстановления.
На втором ТБС операцию необходимо проводить только после того, как первая конечность сможет адекватно использоваться при ходьбе, чаще всего через 2-3 месяца. В некоторых публикациях рекомендуется проводить РА одномоментно с двух сторон, хотя это приводит к большему проценту осложнений.
В послеоперационном периоде не было обнаружено взаимосвязи между костными разрастаниями в области суставной впадины и функциональным состоянием прооперированной конечности.
Основной причиной боли после РА является контакт между костными поверхностями суставной впадины и сегментом бедренной кости, который является следствием неправильно выполненной остеотомии головки и шейки бедренной кости.
У карликовых пород собак в послеоперационном периоде может произойти вывих коленной чашки, в некоторых случаях – на противоположной конечности. Нестабильность коленной чашки у этих животных не влияет на функцию конечности.
Результаты лечения. Правильно выполненная операция обеспечит опорную функцию конечности в течение всей жизни животного. Ряд авторов считает, что РА способна избавить животное от боли при ОА ТБС. Но в любом случае эта операция из-за легкости проведения, относительно небольшой стоимости имеет определенную нишу при лечении собак с тяжелой степенью дисплазии ТБС. Владельцы пациентов должны знать, что после операции возможны определенные нарушения двигательной функции тазовой конечности.
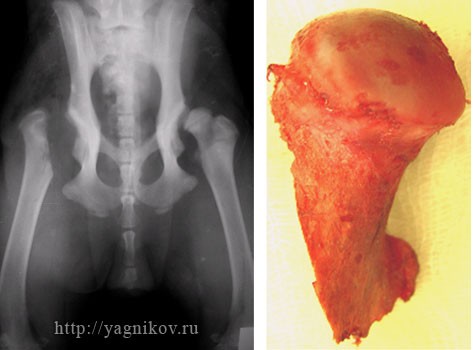
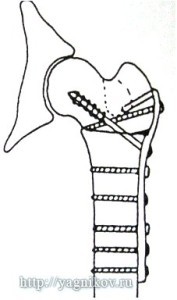
Рисунок. Резекция головки и шейки бедра вместе с малым вертелом у собак крупных и гигантских пород с увеличением шеечнодиафизарного угла и медиализацией малого вертела.
При всех способах оперативной техники резекционная артропластика снижает болевой симптом с увеличением реакции опоры тазовой конечности, но не восстанавливает динамическую функцию конечности. Операция более эффективна у средних пород собак и менее эффективна у крупных и гигантских пород. Интерпозиция мягких тканей между бедренной костью и суставной впадиной ускоряет сроки восстановления двигательной функции конечности, но не влияет на функциональные результаты ходьбы в отдаленные сроки наблюдения. У крупных и гигантских пород собак при увеличении ?ШДУ для максимального восстановления статической функции конечности необходимо вместе с остеотомией головки и шейки бедренной кости выполнять остеотомию малого вертела.
На границе суставная впадина–бедренная кость, независимо от способа выполнения РА, вследствие нарушения кровообращения в интерпонированных между бедренной костью и суставной впадиной аутотканях формируется соединительная ткань, покрытая псевдосиновиоцитами, вырабатывающими жидкость, схожую по физическим и биохимическим показателям с синовией.
В различных ретроспективных исследованиях были зафиксированы долговременные результаты резекционной артропластики ТБС у собак. После окончания фазы восстановления движение без признаков хромоты отмечено у 32-95% собак, периодическая хромота легкой степени – у 16,7-67,7 %, постоянная хромота, усиливающаяся при нагрузке – у 4,2-51,5 %, постоянная хромота тяжелой степени – у 2,2-16,5%. Боль при ротации и отведении тазовой конечности испытывали 33,3-60,5% собак, атрофию мышц после РА имели 97%, а укорочение конечности – 69-87,9%. Хромота после РА рассматривается некоторыми авторами как нарушение биомеханики тазовой конечности, а не проявление боли. Около 90,0% владельцев собак позитивно высказались о полученных результатах операции, причем 71,2% были довольны, а очень довольны – 19,7%.
3.4. Тройная остеотомия таза
После остеотомии костей таза на трех уровнях и ротации остеотомированного сегмента кости с суставной впадиной достигается более адекватное покрытие головки бедренной кости, что приводит к равномерному распределению нагрузки на единицу площади суставной поверхности и замедляет развитие вторичного диспластического остеоартроза. Увеличение стабильности ТБС уменьшает напряжение капсулы сустава и переартикулярной мускулатуры, что снижает болевой симптом.
Показания. Хромота средней или тяжелой степени на тазовые конечности, быстрая утомляемость животного, нарастающая атрофия мышечной массы, лордоз грудино-поясничного отдела позвоночного столба, наличие положительного симптома Ортолани и Барденса сакрализация или люмбализация позвоночного столба, подвывих головки бедренной кости, без признаков вторичного остеоартроза. Определяющим клиническим симптомом для проведения данной операции считали клинический тест: животное под общей анестезией, в боковом положении больной конечностью вверх. Большой палец левой руки врача, проводящего тестирование, упирается в большой вертел бедренной кости собаки. Правой рукой врач давит на коленный суставав, пытаясь сместить головку бедра из суставной впадины. Наличие подвывиха в тазобедренном суставе при абдукции тестируемой конечности на 60-70? по отношению к сагиттальной плоскости тела является противопоказанием к проведению ТОТ.
Противопоказанием служат рентгенограммы подтвердающие разрушение дорсального и кранио-латерального края суставной впадины, признаки вторичного ОА и полный вывих головки бедра на момент обращения. У животного не должна быть выражена атрофия мышц тазового пояса. При полном вывихе головки бедра ТОТ противопоказана.
У собак с увеличением шеечно-диафизарного угла и угла антеторсии вначале необходимо выполнить межвертельную остеотомию, а затем ТОТ. Другие авторы считают, что достаточно только ТОТ.
Возрастные рамки возможного проведения операции. Операция показана собакам крупных и гигантских пород в возрасте от 5 до 12 месяцев, так как в этом возрасте возможна определенная перестройка головки бедра и суставной впадины. Решающим фактором для операции ТОТ является не возраст, а состояние сустава. До развития рентгенологически определяемого ОА прогноз при ТОТ наиболее благоприятный.
ТОТ, должна проводится животным только с клиническими проявлениями дисплазии ТБС. Некоторые авторы рассматривают ТОТ как превентивную операцию и рекомендуют её проводить собакам с дисплазией ТБС до проявления клинической симптоматики.
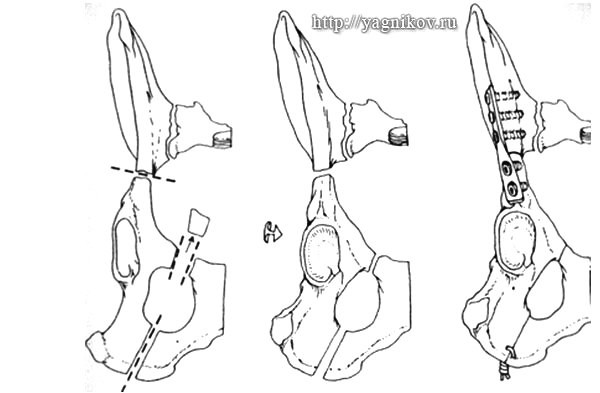
Техника операции. Операция базируется на оригинальной методике Slocum (1986) и включает следующие четыре этапа: сегментарная остеотомия лонной кости; остеотомия седалищной кости; поперечная, или косая остеотомия тела подвздошной кости с последующей ротацией остеотомированного сегмента таза и фиксацией отломков подвздошной кости накостным имплантатом, а седалищных бугров проволочным швом. Для стабилизации использовали три вида имплантатов: реконструктивную пластину, пластину фирмы Numedic, пластину СРОР (Canine Pelvic Osteotomy Plate) Для фиксации пластин к кости использовали кортикальные винты O 3,5 мм и спонгиозные винты O 4,0 мм.
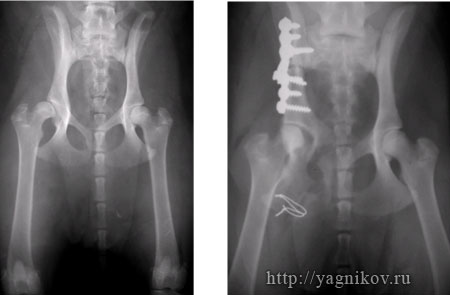
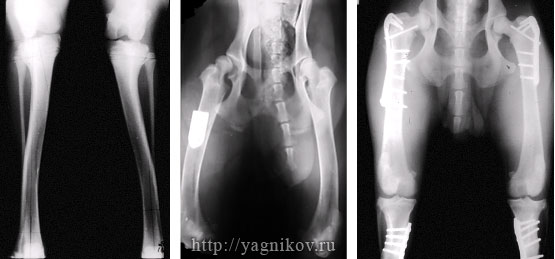
Рисунок. Рентгенограммы таза собаки с дисплазией ТБС. Тройная остеотомия таза справа. Увеличение покрытия головки правой бедренной кости.
В послеоперационном периоде животных ограничивали в движении в течение 6-8 недель, выгуливая на коротком поводке до консолидации костной ткани на уровне остеотомий. Собаки на 2-3 сут после операции с поддержкой под живот могут самостоятельно вставать, стоять и ходить .
Полное восстановление функции конечности следует ожидать к 12-16 недельному сроку. Операцию на противоположной половине таза можно выполнять через 3-4 месяца, а при создании постоянного покоя через 3-4 недели. Для предотвращения прогрессирования остеоартроза во втором ТБС ТОТ у молодых животных рекомендуют выполнять одномоментно. Большинство собак, по утверждению владельцев, могли самостоятельно ходить на 3-4 сутки после операции. Пластины, используемые для остеосинтеза, не удаляют, так как они не вызывают осложнений в послеоперационном периоде, а травма при их удалении велика.
3.5. Межвертельная остеотомия
Показания. Операция рекомендована собакам с увеличенными ?ШДУ и ?АТ, что приводит к подвывиху головки бедренной кости из суставной впадины, уменьшает площадь контакта между суставными поверхностями ТБС и увеличивает давление на единицу поверхности суставного хряща, что ведет к развитию вторичного остеоартроза, боли и хромоте.
Операцию рекомендуют проводить в период роста от 6 до 10 мес, так как у молодых животных сохраняется способность к ремоделированию костей, формирующих ТБС, что определяет прочное суставное сочленение. Однако у каждого автора в этом возрастном интервале есть более точные возрастные рамки: 7 мес, 6-8 мес, 10-12 мес. Верхней возрастной границей для межвертельной остеотомии считают возраст 12-16 мес.
Межвертельная остеотомия (МО) наиболее эффективна у животных без рентгенографических признаков вторичного остоартроза на момент операции. Этот критерий сочетается с пациентами в возрасте до 1 года. Противопоказанием к операции являются вывих головки бедра из суставной впадины, отчетливые изменения формы головки бедра и разрушение краниолатерального и дорсального краев суставной впадины. Но даже у собак с наличием вторичного ОА отмечали уменьшение болевого симптома, снижение хромоты и увеличение активности животного.
В отношении влияния данной операции на развитие вторичного остеоартроза в литературе нет единства мнений: вторичный остеоартроз прогрессирует, МО сдерживает развитие вторичного ОА, и более оптимистичное мнение, что МО предотвращает развитие ОА.
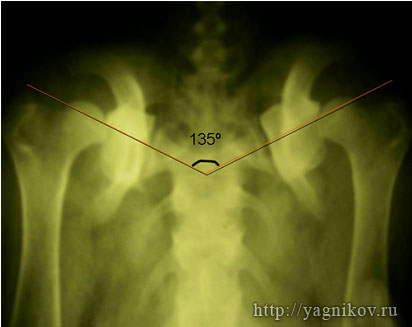
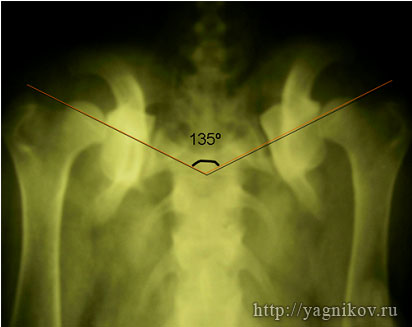
Для получения стабильного сочленения головки бедра в суставной впадине необходима коррекция ?ШДУ до 135?. Для этого необходимо выполнить остеотомию клина в межвертельной области величиной 20-35?.
При одномоментном увеличении ?АТ одномоментно выполняется деротация проксимального сегмента бедра до получения максимально конгруэнтного соотношения головки и суставной впадины. Фиксацию остеотомированных фрагментов выполняют крюкообразной DCP – пластиной.
На первый – второй день после операции собака должна нагружать оперированную конечность. Животное ограничивают в движениях, гуляя на поводке 4-5 недель, 6-8 недель .
Операцию на противоположном ТБС, выполняют после сращения отломков кости через 4-6 недель.
Пластины и винты, использованные для фиксации остеотомированных отломков кости, не удаляют, если нет клинических показаний, так как такая операция является достаточно травматичной. Пластины у молодых собак могут нарушать рост кости в длину, вызывать некроз подлежащей кости вследствие давления и нарушения кровообращения, что является аргументом в пользу удаления имплантатов.
Осложнения при выполнении МО описываются редко. Хромота в послеоперационном периоде может быть следствием травмирования седалищного нерва или перелома шейки бедра при неконтролируемой активности животного.
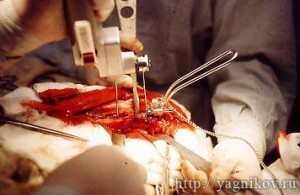 Техника операции. Для выполнения операции использовали специальный набор для межвертельной остетомии AO ASIF и 5-7 гнездные крюкообразные пластины DCP под винты 3,5 мм. К проксимальному сегменту бедра выполняли краниолатеральный доступ, с рассечением m.tensor fascia lata по краниальной границе m. biceps femoris, со смещением m. biceps femoris каудально, отсечением сухожильного окончания m. gluteus superficialis и смещением его дорсально и отпрепаровыванием от проксимального сегмента бедра m.vastus lateralis. На латеральной поверхности бедренной кости, отмечали линию остеотомии, которая соответствовала уровню малого вертела. С помощью специального шаблона в большом вертеле бедренной кости формировали для отверстия O 3,2 мм под крюкообразную DCP пластину. В просверленные отверстия вставляли шаблон для проведения остеотомии на заданном уровне. Окружающие ткани предохраняли с краниальной и каудальной стороны ложками Буяльского или крючками Хомана. Остеотомию выполняли осцилляторной пилой, постоянно охлаждая кость холодным физиологическим раствором. После проведения остеотомии, на шаблоне устанавливали необходимый уровень клиновидной остеотомии, исчисляемый в градусах. Осцилляторной пилой выполняли клиновидную остеотомию. Изменив ?ШДУ и ?АТ, фиксировали отломки костодержателем-цапкой, а затем пластиной. Ушивание раны: m.vastus lateralis накладывли на пластину и подшивали к окружающим тканям, m. gluteus superficialis укорачивали и подшивали к пластине, m.tensor fasciaе lataе сшивали с m. biceps femoris. Кожу закрывали обычным способом.
Техника операции. Для выполнения операции использовали специальный набор для межвертельной остетомии AO ASIF и 5-7 гнездные крюкообразные пластины DCP под винты 3,5 мм. К проксимальному сегменту бедра выполняли краниолатеральный доступ, с рассечением m.tensor fascia lata по краниальной границе m. biceps femoris, со смещением m. biceps femoris каудально, отсечением сухожильного окончания m. gluteus superficialis и смещением его дорсально и отпрепаровыванием от проксимального сегмента бедра m.vastus lateralis. На латеральной поверхности бедренной кости, отмечали линию остеотомии, которая соответствовала уровню малого вертела. С помощью специального шаблона в большом вертеле бедренной кости формировали для отверстия O 3,2 мм под крюкообразную DCP пластину. В просверленные отверстия вставляли шаблон для проведения остеотомии на заданном уровне. Окружающие ткани предохраняли с краниальной и каудальной стороны ложками Буяльского или крючками Хомана. Остеотомию выполняли осцилляторной пилой, постоянно охлаждая кость холодным физиологическим раствором. После проведения остеотомии, на шаблоне устанавливали необходимый уровень клиновидной остеотомии, исчисляемый в градусах. Осцилляторной пилой выполняли клиновидную остеотомию. Изменив ?ШДУ и ?АТ, фиксировали отломки костодержателем-цапкой, а затем пластиной. Ушивание раны: m.vastus lateralis накладывли на пластину и подшивали к окружающим тканям, m. gluteus superficialis укорачивали и подшивали к пластине, m.tensor fasciaе lataе сшивали с m. biceps femoris. Кожу закрывали обычным способом.
Рисунок. Рентгенограммы коленного сустава и таза у собаки с вальгусной деформацией тазовых конечностей (Genu valgum). Увеличение шеечнодиафизарного угла. Межвертельная остеотомия бедренных костей и клиновидная остеотомия обоих большеберцовых костей.
Результаты лечения. Улучшение функции оперированной конечности у 53,5% собак было отмечено в первый месяц после операции, 14,2% показали улучшение через 2 мес, 7,6% – в интервале между 2-3 мес, а оставшиеся пациенты – в сроки более 3 мес. При этом 40,4 – 60,6% собак при длительной нагрузке не имели жалоб, 21,2 – 49,2% имели легкую хромоту после нагрузки. У 6% собак операция не привела к улучшению функции конечности, а у 4,4% животных после операции отмечено усиление хромоты. Лучшие клинические результаты наблюдались у собак без признаков вторичного ОА на момент операции.
По истечении трех лет 92% хозяев заметили, что если бы сложились такие же обстоятельства, они бы дали согласие на МО.
3.6. Тотальное эндопротезирование ТБС
Искусственная замена головки бедренной кости и суставной впадины (тотальное эндопротезирование – ТЭП, называемое также аллоартропластика) при дисплазии ТБС является значительным достижением ветеринарной хирургии. В начале своего развития с 1938 г. ортопедическая ветеринарная медицина шла в направлении создания протеза головки и шейки бедренной кости. Но плоская суставная впадина приводила к подвывиху или вывиху головки протеза, что ставило под сомнение эффективность метода. Впервые тотальный эндопротез ТБС был разработан Gormann в 1957г.. Оба компонента эндопротеза были изготовлены из нержавеющей стали. Чашку фиксировали в костях таза тремя шурупами, а бедренный компонент – в интрамедуллярном канале бедренной кости. Одним из недостатков данного протеза была несостоятельность первичной фиксации чашки и бедренного компонента эндопротеза, что приводило к его нестабильности. К первым моделям относится так же протез Creed (1971). Его особенностью был винилиденовый вкладыш в чашке эндопротеза. Но он имел те же недостатки, что и предыдущий. Попытка апробировать тефлон в качестве покрытия узла трения протеза была неудачной: он был легко подвержен износу. Punzet и Zweymuller (1979) использовали в качестве головки имплантат из алюминий-оксид-керамики, но использование данной технологии часто приводило к перелому имплантата .
С началом использования в семидесятые годы прошлого столетия для первичной фиксации эндопротезов цемента, состоящего из полиметилметакрилата, удалось значительно увеличить продолжительность срока службы эндопротезов. На сегодняшний день в ветеринарной медицине широко используются эндопротезы только с первичной фиксацией цементом.
Прототипом всех известных эндопротезов в ветеринарии послужил протез Richards Canine тип II. Данная модель протеза имела несколько типоразмеров в зависимости от величины суставной впадины и интрамедуллярного канала бедренной кости собаки и состояла из чашки, изготовленной из высокомолекулярного полиэтилена, и бедренного компонента из кобальтохромового сплава. Протез имел малую величину износа в узле трения и фиксировался костным цементом. Для предотвращения вывиха головки из чашки протеза в раннем послеоперационном периоде в США в 1990 году внедрен модульный протез BioMedtrix. Почти одновременно во Франции создан модульный эндопротез с биомеханической интеграцией. Особенностью данного протеза является то, что длина шейки может изменяться, чтобы сохранить напряжение между чашкой и головкой протеза и снизить опасность люксации в раннем послеоперационном периоде. В протезе «Aesculap» (Германия) для избежания риска люксации изготовлена защелкиваемая впадина. В конструкции данного протеза имеются специальные узкие ножки для немецких овчарок. Чашка протеза также изготовлена из высокомолекулярного полиэтилена, в то время как бедренный компонент протеза – из литого сплава кобальт-хром-молибдена .
Для предотвращения люксации головки была сконструирована захлопывающаяся чашка, имеющая полиэтиленовый вкладыш и металлическую основу чашки. Данная конструкция уменьшает «раскатывание» и расширение полиэтилена, что препятствует вывиху .
Тотальное эндопротезирование ТБС с первичной фиксацией костным цементом успешно применяется в ветеринарии. Бесцементная техника протезирования в ветеринарной медицине не нашла широкого применения, и её использование находится на стадии эксперимента, хотя современная концепция эндопротезирования в гуманной медицине – использование именно бесцементной техники фиксации эндопротезов . Основная концепция стабильной фиксации бесцементного эндопротеза – врастание костной ткани в металлическую поверхность протеза – «bony ingrowth». Для выполнения этой цели поверхность ножки и чашки эндопротеза должны иметь порозную поверхность и плотный контакт по всей поверхности кость – имплантат. В гуманной медицине выполнение этих условий достигается большим количеством типоразмеров ножек и чашек протезов и возможностью расточить интрамедуллярный канал бедренной кости, значительно не ослабив его, так как кортикальная кость бедра у человека имеет толщину 5-7мм .
К недостаткам бесцементного протезирования относят возросшую стоимость имплантата и более сложную технику операции, требующую большого количества специального инструментария. Наличие небольшой щели (0,5мм) на границе кость – имплантат в период первичной фиксации протеза препятствует врастанию костной ткани. Бороться с данной проблемой можно только посредством максимального соответствия поверхности имплантата поверхности интрамедуллярного канала, что требует индивидуального подхода к пациенту, изготовления большого количества типоразмеров протезов, что приведет к значительному повышению стоимости имплантата. Растачивание интрамедуллярного канала ввиду тонкого кортикального слоя кости у собак и большой вероятности перелома не рекомендуется.
В отношении перспективы использования бесцементных протезов существует несколько мнений: развитие бесцементного протезирования в ветеринарии должно идти параллельно с цементным эндопротезированием (72); нет необходимости в использовании в ветеринарии бесцементных эндопротезов (331). На сегодняшний день нет никаких отдаленных результатов использования бесцементных эндопротезов у собак. На вопрос о том, следует ли отказаться от костного цемента, ответит будущее.
Показания. Имплантация эндопротеза показана собакам с тяжелой степенью дисплазии ТБС, вторичным ОА и острыми болями при ходьбе. Эндопротезирование ТБС — «спасательное мероприятие», к которому прибегают только тогда, когда реконструктивно-восстановительные операции с сохранением сустава не будут иметь никакого успеха. Ряд авторов рекомендует более радикальный подход. При наличии стойкого болевого симптома операция показана и при средней степени дисплазии. Собаки без наличия клинической симптоматики, несмотря на рентгенологически определяемые изменения тяжелой степени в ТБС, не являются кандидатами для оперативного вмешательства. Оперативное вмешательство при нарастающей мышечной атрофии на фоне дисплазии ТБС должно быть выполнено в ранние сроки, так как собаки с хорошей мышечной массой имеют более короткие сроки реабилитации и максимальное восстановление функции. При выраженной мышечной атрофии следует полностью отказаться от проведения имплантации протеза ТБС, так как возникает нефизиологическое движение тазовой конечности, которое не может быть компенсировано эндопротезом и может привести к люксации.
Операция рекомендуется животным после завершения роста и оссификации эпифизарных зон. Минимальный возраст собак для эндопротезирования сустава варьирует от 8 до 12 и даже 14 месяцев. Однако животные, прооперированные в возрасте 5-11 месяцев, не имели негативных осложнений, связанных с возрастом. Имеются сообщения об операциях у собак в возрасте 13 и более лет.
Эндопротезирование ТБС целесообразно выполнять собакам массой более 20 кг. Это обусловлено экономической и функциональной целесообразностью. Собаки с массой менее 20 кг имеют удовлетворительные результаты лечения после резекционной артропластики ТБС. Последние исследования по эндопротезированию ТБС у мелких пород собак показывают функциональный приоритет эндопротезирования сустава над резекционной артропластикой. Даже у собак с массой тела 8 кг имплантация эндопротезов была успешной. В ряде работ масса тела 30 кг указана как наиболее оптимальная для эндопротезирования ТБС. Верхней границы массы тела для эндопротезирования ТБС нет.
Имплантация эндопротеза может быть выполнена животному после неудачно проведенной РА ТБС. Однако эндопротезирование ТБС не позволяет значительно улучшить функциональные результаты тазовой конечности и имеет больший процент осложнений и значительные технические трудности. Эндопротезирование у собак с неудачно проведенной РА и плохими функциональными результатами противопоказано из-за образования рубцовых тканей, деформации кости и довольно сложной техники имплантации протеза.
Противопоказанием к эндопротезированию ТБС служат неврологические заболевания: дегенеративная миелопатия, грыжа межпозвонкового диска, компрессия Cauda equina – и опухоли позвоночного столба или нервной ткани. Злокачественные и неоперабельные опухоли также являются противопоказанием для протезирования, так как может активизироваться основное заболевание. До проведения операции необходимо купировать все локальные очаги инфекции: пиодермию, цистит, простатит, отит, перианальный синусит, чтобы предотвратить гематогенное занесение инфекции в область операционной раны. Хронические заболевания сердца, печени и почек исключают проведение хирургического вмешательства (304).
Операционная техника. Вмешательство следует проводить при соблюдении строгой асептики, специально обученным хирургом, что позволит на 2/3-1/2 снизить количество осложнений. Для эндопротезирования ТБС использовали специальный наборы SYNTHES и AESCULAP, для имплантации протезов. В предоперационном периоде, на основании выполненных рентгенограмм таза в I и II позициях, подбирали соответствующего размера чашку и ножку эндопротеза.
Собаку укладывали в боковое положение, больной конечностью вверх. К тазобедренному суставу выполняли один из доступов: краниодорсальный с тенотомией m. gluteus profundus или краниодорсальный и каудодорсальный доступ с остеотомией trochanter major. Следующим этапом выполняли артротомию ТБС. Ротировали тазовую конечность, так чтобы коленная чашка приняла вертикальное положение, и удерживали в данной позиции. С помощью шаблона бедренного компонента эндопротеза, определяли уровень остеотомии головки и шейки бедренной кости. Осциилляторной пилой проводили остеотомию головки и шейки бедра с заданным углом наклона. С помощью трех-четырех ретракторов Хомана раскрывали полость суставной впадины. Кюреткой удаляли остатки lig.teres. Поэтапно, увеличивая диаметр фрезы (шорожки) рассверливали суставную впадину до нижнего уровня fossa acetabuli. Из полости суставной впадины в теле подвздошной и седалищной костей бором формировали три полости диаметром до 0,5-0,8 см.
Ретрактором Хомана поднимали проксимальный сегмент бедра до уровня поверхностных мягких тканей. Вскрывали стилетом интрамедуллярный канал бедренной кости. Рашпилем растачивали интрамедуллярный канал до свободного прохождения ножки эндопротеза. На уровне дистального полюса ножки эндопротеза плюс 1,5 см, через кортикальную кость, перекрестно проводили две спицы Киршнера O 1,5-1,8 мм. В интрамедуллярный канал помещали «пробку» препятствующую миграции цемента ниже установленного уровня. «Пробку» готовили из остеотомированной шейки и головки бедра. При склерозе остеотомированного сегмента шейки и головки бедра в качестве пробки использовали силиконовый протез. Проводили санацию полости интрамедуллярного канала для удаления мелких фрагментов костной ткани и крови и затем туго тампонировали салфеткой или специальной гемостатической губкой.
Имплантацию ножки эндопротеза проводили после удаления салфетки или гемостатической губки из полости интрамедуллярного канала. Вставляли в канал тонкий полиэтиленовый катетер для отхождения воздуха и крови при заполнении полости цементом. Специальным пистолетом под давлением вводили в полость интрамедуллярного канала костный цемент. Затем имплантировали бедренный компонент эндопротеза с заданным углом антеторсии – 10? и удерживали в заданном положении до полной полимеризации цемента, постоянно орошая кость холодным раствором. Удаляли спицы, блокирующие пробку в канале кости.
Имплантацию чашки эндопротеза проводили после санации суставной впадины и охлаждения костной ткани раствором Рингера. Заданные угловые характеристики чашки (угол наклона чашки 45?, угол антеверсии 10?) устанавливали с помощью импактора. В заданном положении удерживали чашку и удаляли излишки цемента до момента его полимеризации.
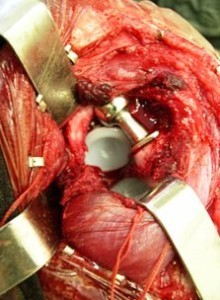 При значительном разрушении дорсального и краниолатерального контуров суставной впадины, выполняли костную пластику. В качестве пластического материала использовали губчатую аутокость из резецированной головки бедренной кости, крыла подвздошной кости или костные «чипсы» из проксимального метафиза плечевой кости.
При значительном разрушении дорсального и краниолатерального контуров суставной впадины, выполняли костную пластику. В качестве пластического материала использовали губчатую аутокость из резецированной головки бедренной кости, крыла подвздошной кости или костные «чипсы» из проксимального метафиза плечевой кости.
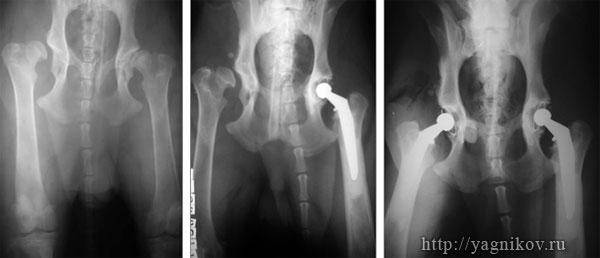
Рисунок. Макрофото. Фиксация на костный цемент «ножки» и «чашки» зндопротеза.
Для более адекватной консолидации пластического материала и края суставной впадины, разрушали кортикальную пластинку последней низкоскоростным бором. В качестве фиксирующих аутокость имплантатов использовали кортикальные винты диаметром 2,7 мм и/или реконструктивную пластину с винтами 2,7 мм. Во всех случаях фиксацию чашки выполняли после костной пластики суставной впадины при обильном орошении костной ткани физиологическим раствором в момент полимеризации цемента.
Вправляли головку протеза в чашку, восстанавливали капсулу сустава простыми узловыми швами капроном, накладывали сухожильно-мышечный шов на m. gluteus profundus. При краниодорсальном и каудодорсальном доступе с остеотомией trochanter major фиксировали последний двумя спицами Киршнера и проволочным 8-образным швом по Веберу или спонгиозным компрессирующим винтом. При стабильном положении компонентов эндопротеза рану ушивали послойно наглухо.
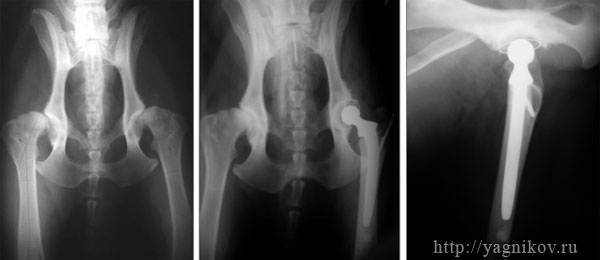
Рисунок. Рентгенограмма таза собаки с двухсторонней дисплазией ТБС в прямой проекции (а). Тотальное поэтапное эндопротезирование левого и правого ТБС Щвейцарскими эндопротезами фирмы MATHYS. Срок наблюдения 1569 суток.
При тенденции к подвывиху выполняли переартикулярную стабилизацию крупноячеистой лавсановой лентой шириной до 4-6 мм. Билатерально от чашки эндопротеза просверливали два отверстия O 4,5 мм. Фиксировали лавсановую ленту в теле подвздошной и седалищной костей с помощью спицевого фиксатора восьмерко-образной формы, блокирующего ленту в просверленных отверстиях. Свободные концы ленты (по два с каждой стороны) проводили перекрестно над капсулой сустава. Просверливали два поперечных отверстия диаметром 2,5 мм в бедренной кости на уровне головки эндопротеза, через которые проводили свободные концы лавсановой ленты, фиксированной в костях таза, и связывали их с двумя свободными концами той же ленты, стабилизируя головку эндопротеза в чашке.
Послеоперационное лечение. Для предотвращения вывиха в послеоперационном периоде рекомендовано ограничение движений (содержание в клетке) от 3 до 28 суток. Некоторые авторы считают достаточным содержание в стационаре после операции до 48 часов.
Рисунок. Рентгенограмма таза в первой позиции с дисплазией тазобедренных суставов тяжелой степени (а). Тотальное эндопротезирование левого тазобедренного сустава эндопротезом фирмы AESCULAP (б, в).
Для предотвращения разлизывания раны рекомендуется одевать животным воротник «Елизаветы» или накладывать повязку на обе тазовые конечности, что предотвращает разлизывание и минимизирует объем движений в суставах, препятствуя вывиху эндопротеза. В течение 3-12 недель собакам после операции необходимо создать ограничение движений (прогулки на поводке. При имплантации протеза без цемента не требуется длительного ограничения движений в послеоперационном периоде.
Собаки начинают опираться на конечность с первого – второго дня после операции, а полное восстановление опорно-двигательной функции происходит через 4-6-8 недель.
Осложнения. Внезапная потеря опороспособности на оперированную конечность говорит о серьезных осложнениях, возникших после эндопротезирования ТБС. Наиболее частым осложнением является вывих головки бедренного компонента эндопротеза, который происходит в течение первых четырех недель после операции. Причинами вывиха являются: расхождение швов, наложенных на капсулу сустава, при активных движениях собаки; атрофия переартикулярных мышц; имплантация чашки с нарушением угловых параметров и выбор ножки эндопротеза с недостаточно длиной шейкой.
Наиболее серьезным осложнением при имплантации эндопротеза является остеомиелит, который может быть следствием нарушения асептики или эндогенного инфицирования раны. Гематогенное инфицирование раны может возникнуть через год и более длительный срок после эндопротезирования ТБС. Риск занесения инфекции увеличивается при ревизии эндопротеза. Поэтому в течение всей жизни пациенты подвергаются опасности возникновения осложнений.
Причиной хромоты после эндопротезирования ТБС может быть асептическая нестабильность эндопротеза. Асептическая нестабильность проявляется в первые два года после операции. Причины асептической нестабильности: неправильная техника цементирования при имплантации протеза и продукты разрушения узла трения эндопротеза, которые вызывают остеолизис на границе кость – имплантат. Послеоперационная активность животного не играет никакой роли в развитии асептической нестабильности.
Благодаря развитию стандартизированных, асептических техник при имплантации эндопротезов можно избежать послеоперационных осложнений, таких как асептическая нестабильность, вывих головки бедренного компонента и остеомиелит. Таким образом, замена ТБС эндопротезом с первичной фиксацией цементом, проводимая опытным ветеринарным хирургом, имеет незначительный риск. Согласно опубликованным исследованиям последних 10-ти лет, в рамках которых было обследовано большое количество пациентов в течение длительного периода времени, процент асептической нестабильности составляет от 2,7% до 5,8% , инфекционных осложнений от 0% до 5% и для люксаций 1%– 4,6%.
К редким осложнениям при тотальном эндопротезировании ТБС относят повреждение седалищного нерва в виде растяжения, ущемления или ожога в период полимеризации цемента. Восстановление проводимости нерва и двигательной функции конечности происходит в течение 7–30 дней после травмы. В период реабилитации необходимо забинтовать дорсальную сторону стопы тазовой конечности .
Также, в некоторых случаях, наблюдали эмболию легочной артерии или ее ветвей со смертельным исходом во время или после операции.
Большинство осложнений, возникающих после имплантации тотального эндопротеза, фиксируемого цементом, происходит через 1,5 года после операции.
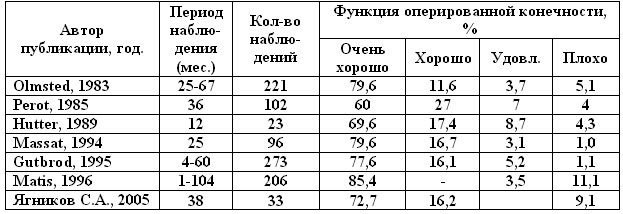
Результаты. Результаты тотального эндопротезирования ТБС можно проследить на основании опубликованных работ (табл.4).
Таблица 4. Функциональные результаты тазовой конечности после замещения ТБС эндопротезом. O
Как видно из таблицы 1,60–85,4% животных не имели каких-либо признаков щажения оперированной тазовой конечности даже после длительной нагрузки. 11,6–27% имели хромоту легкой степени после длительной нагрузки или вначале движения. Постоянную хромоту от слабой до средней степени имели 3,1–8,7% собак, а хромоту тяжелой степени 1,0–11,3%. На основании полученных послеоперационных рентгенограмм не
возможно прогнозировать восстановление функции конечности и возможные послеоперационные осложнения.
Подводя итог, на основе высокой квоты (почти в 90% случаев получены очень хорошие и хорошие клинические результаты у собак с выраженными изменениями в ТБС) следует заключить, что имплантация эндопротезов, фиксируемых цементом, имеет многообещающий прогноз, что подтверждено длительностью наблюдения. В отношении бесцементных протезов ТБС до сих пор нет сравнительных исследований и длительных наблюдений, поэтому необходимы дальнейшие исследования и оценка результатов. Имеющиеся в распоряжении результаты по бесцементному эндопротезированию являются стимулом для продолжения исследований.
Список литературы:
- Алексеева Л.И., Беневоленская Л.И., Насонов Е.Л. и др.: Структум (хондроитинсульфат) – новое средство для лечения остеоартроза. // Ж. Терапевтический архив. 1999, 5, 51-53.
- Алексеев А.В., Муравьев Ю.В.: Подходы к прогнозированию риска возникновения гастропатий, вызванных нестероидными противовоспалительными препаратми. // Ж. Терапевтический архив. 2000, 5, 25-28.
- Без авторов: Клинические аспекты применения препарата «Синвиск». // Ж. Мargo Anterior. 2002, 4, 5-8.
- Героева И.Б., Цикунов М.Б: Консервативное лечение остеоартроза крупных суставов. // Вестник травматологии и ортопедии им. Н.Н. Приорова. 1994, 3, 51-55.
- Дедух Н.В., Панков Е.Я.: Гормональная регуляция процессов развития и роста хрящей.// Ж. Успехи современной биологии. 1988, 6, 454-469.
- Дедух Н.В., Зупанец И.А.: Остеоартрозы – пути фармакологической коррекции. // Харьков. 1992, 55-56.
- Орехова О.И.: «Протез синовиальной жидкости»-новый метод лечения деформирующего остеоартроза коленного сустава. // Ж. Margo Anterior. 1999, 5, 1-2.
- Каратеев А.Е., Насонова В.А., Муравьев Ю.В.: Оценка влияния глюкокортикостероидных и нестероидных противовоспалительных препаратов на развитие эрозивно-язвенного поражения желудочно-кишечного тракта у больных с ревматическими заболеваниями. // Ж. Терапевтический архив. 1999, 2, 26-30.
- Митин В.Н., Ягников С.А., Любимов В.А. Рентгенологическая диагностика дисплазии тазобедренных суставов у собак. «Ветеринар», 1999, 7-9, 25-33.
- Митин В.Н., Ягников С.А. Дисплазия тазобедренных суставов. Справочник. Под ред. Майорова А.И. Болезни собак. М., «Колос», 2001, 277-294.
- Митин В.Н., Ягников С.А. Отдаленные результаты тотального эндопротезирования тазобедренного сустава при его дисплазии у собак. «Российский ветеринарный журнал». М., «Колос» 2005, 1, 2-5.
- Насонова В.А.: Новые данные о клинической эффективности и переносимости мелоксикама (Мовалиса). // Ж. Терапевтичсекий архив. 1999, 11, 45-48.
- Самошкин И.Б. Реконструктивно-восстановительные операции при врожденной и посттравматической патологии тазобедренного сустава у собак. Автореф. докт. вет. наук. М., 1999.
- Стекольников А.А., Лебедев А.В., Бацанов Н.П., Жигачев А.И., Александров В.А. Дисплазия тазобедренных суставов в племенном собаководстве. Методические рекомендации. Санкт-петербург, 1999, 1-23.
- Тареева И.Е., Андросова С.О.: Влияние ненаркотических анальгетиков и нестероидных противовоспалительных препаратов на почки. // Ж. Терапевтический архив. 1999, 6, 17-22.
- Хитров Н.А., Сильвестров В.П., Цурко В.В.: Сравнительная оценка методов локальной терапии при лечении деформирующего остеоартроза. // Ж. Терапевтический архив. 1997, 2, 53-54.
- Цурко В.В., Хитров Н.А.: Остеоартроз. // Ж. Терапевтический архив. 2000, 5, 62-66.
- Шабалаев И.В. Лечение собак при коксите. Ветеринария. 1998, 10, 60.
- Шостак Н.А., Аксенова А.В., Рябкова А.А., Федоров Е.Д. и др.: О желудочно-кишечных кровотечениях, индуцированных нестероидными противовоспалительными препаратами. // Ж. Терапевтический архив. 2000, 5, 60-61.
- Ягников С.А., Митин В.Н., Гаврюшенко Н.С. Исследование пары трения эндопротезов тазобедренного сустава для собак, представленных на отечественном рынке. «Ветеринар». 2001, 4, 20-24.
- Ягников С.А., Мицкевич В.А., Шальнев А.Н., Митин В.Н. Анализ опорной функции конечностей у собак с дисплазией тазобедренных суставов с помощью сенсорной платформы до и после оперативного лечения. «Вестник ветеринарной медицины». 2002, 4, 14 – 18.
- Ягников С.А., Митин В.Н. Оперативные методы лечения диспластического коксартроза у собак. «Вестник Российской академии сельскохозяйственных наук». 2003, 6, 67 – 68.
- Ягников С.А. Резекционная артропластика тазобедренного сустава у собак. «Ветеринария». 2003, 12, 50-53.
- Ягников С.А., Митин В.Н. Стабилизация чашки эндопротеза у собак с дисплазией тазобедренного сустава. «Ветеринария». 2003, 9, 47-48.
- Ягников С.А. Консервативное лечение остеоартроза крупных суставов у собак. «Вестник ветеринарной медицины». 2004, 1, 7-11.
- Ягников С.А., Кулешова Я.А., Захарова М.М., Роденска-Лоповок С.Г. Динамика изменений синовиальной жидкости, суставного хряща и опорной функции конечности, при лечении вторичного остеоартроза крупных суставов у собак препаратом Хионат. Часть I. «Ветеринарная клиника». 2004, 12, 20 – 25.
- Ягников С.А., Кулешова Я.А., Захарова М.М., Роденска-Лоповок С.Г. Динамика изменений синовиальной жидкости, суставного хряща и опорной функции конечности, при лечении вторичного остеоартроза крупных суставов у собак препаратом Хионат. Часть II. «Ветеринарная клиника». 2005, 1, 19-20.
- Ягников С.А., Кулешова Я.А., Захарова М.М., Роденска-Лоповок С.Г. Изменение структуры суставного хряща и течения вторичного остеоартроза у собак на фоне лечения препаратом Хионат. «Сельскохозяйственная биология». 2005, 6, 92-95.
- Ягников С.А. Тройная остеотомия таза (показания, техника операции, результаты). «Российский ветеринарный журнал». М., «Колосс» 2005, 3, 13-17.
- Ягников С.А. Дисплазия тазобедренного сустава у собак. Состояние вопроса. «Ветеринарная патология» 2006, 2, 46-48.
- Ягников С.А. Оперативное лечение дисплазии тазобедренного сустава у собак (обоснование, методы, результаты). Диссертация на соискание ученой степени доктора ветеринарных наук. Санкт-Петербург – 2005 г.
- Adolphe V., Blondelon D., Lechat P.: Glucocorticoid Receptors in Rabbit Cultured Chondrocytes. //J. In vitro. 1980, 3, 239.
- Anderson M. : Oral Chondroprotecyive Agents. Part II. // J. Compendium. 1999, 9, 861-865.
- Bari S.M., Carter S., Bell S., et al.: Anty-type II collgen antibody in natyrally occurring canine join diseases. // Br. J. Rheumatol. 1989, 28, 480-486.
- Belfield W.O.: Complementary and alternative veterinary medicine, in Schoen AM, Wynn SG(eds).// Complementary and Alternative Veterinary Medicine. Fhiladelphia, Mosby, 1998, 113-129.
- Bennett D.: Osteoarthritis – definition and current treatment options. // Berlin, 2001, European Congress.
- Benton H., Vasseur P., Broderick – Villa G.: Effect of carprofen on sulfated glucosaminoglycan metabolism, protein synthesis, and prostaglandin release by cultured osteoarthritic canine chondrocytes. // American Journal of veterinary Research. 1997, 58, 286-292.
- Bergman J.: Treatment of dogas suffering from arthrosis with Quadrisol 5, a gel containing vedaprofen, a nev NSAID. // Intervet International. Pre-clinical and clinical documentation. 1997, 1-13.
- Bonnet D.: Can gene therapy be used to treat arthritis? // 1999.
- Boothe D.: Nutraceuticals in veterinary medicine. Part I. Definitions and regulations. // J. Compendium. 1997. 19. 1248-1255.
- Brinker W., Piermattei D., Flo G.: Orthopadie und Frakturbehandlung beim Kleintier. // 1993, Verlag Schattauer.
- Bucci L.:Fatty acids and lipids, in Bucci L(ed).// Nutrition Applied to Injury Rehabilitation and Sports Medicine.1995, 53-58.
- Clark D.: Degenerative joint disease. // Saunders manual of small animal practice, Saunders Company. 1994, 1101-1103.
- Curtis С., Hughes C., Flannery C., Little C.: “N-3 fatty acids specifically modulate catabolic factors involved in articular cartilage degradation”.// Journal of Biological chemistry. 2000, 275(2), 721 – 724.
- Davidson G. : Glucosamine and chondoitin sulfate. // J. Compendium. 2000, 5, 454-458.
- Denny H.: A guide to canine and feline orthopaedic surgeru. // 1997, Blackwell Scentific Publications.
- Durkes T.: Gold bead implants. // Veterinary acupuncture. American Veterinary Publication inc., Goleta, 1994, 285-289.
- Evans C., Robbins P.: Human Gene Therapy.// 1996, 7, 1261-1280.
- Galbraith E., McKellar Q.: Pharmacokinetics and pharmacodynamics of piroxicam in dogs. // J. Veterinary Record. 1991, 128, 561-565.
- Gibson T., Burry H.C., et all.: Effect of intraarticular corticosteroid injections on primate cartilage. // J. Ann. Rheum. 1977, 36, 74–78.
- Goldberg V.M., Moskowitz R.W.: Effects of intraarticular corticosteroids and exercise in experimental models of arthritis. // Proc. Twenty-second Annual Meeting Orthopaedic. 1976, 1, 24
- Gray R.G., Gottirb N.Z.: Intraarticular Corticosteroids. // Clin. Orthopadiecs and releated research. 1983, 235-264.
- Grosse M., Kohn B., Nuernberger M. et al.:Klinische Wirksamkeit und Vertaglichkeit von meloxicam nach der Operation des Kreuzbandrisses beim Hund. // J. Kleintierpraxis, 1999, 3, 155-164.
- Hendriks S., Bergman J.: A placebo-controlled trial with Quadrisol 5 in dogs after surgery of the elbow joint. // J. Small animals. 1999, 18, 1-3.
- Hurtig M. et al.: Proceedings of the veterinary Orthopaedics Society.// 1998, U.S.A.
- Innes J., Barr A., Sharif M.: Efficacy of oral calcium penthosan polysulphate for the treatment of osteoarthritis of the canine stifle joint secondary to cranial cruciate ligament deficiency. // J. Veterinary Record 2000, 146 (15), 433-437.
- Johnston S.: Conservative and medical management of hip displasia.// J. Veterinary Clinics of North America: Small animal practice. 1992, 22, 595-606.
- Johnston S.: Osteoarthritis. // J. Veterinary Clinics of North America: Small animal practice. 1997, 27, 699-723.
- Johnston S., Budsberg S.: Nonsteroidal anti-inflammatory drugs and corticosteroids for the management of canine osteoarthritis. // J.Veterinary Clinics of North America: Small animal practice. 1997, 27, 841-862.
- Johnston S., Leib M., Forrester S. et al.: The effects of misoprostol on aspirin-induced gastroduodenal lesions in dogs. // J. Veterinary Internal Medicine. 1995, 9, 32-38.
- Justus C.: Clinical efficacy and tolerance of Metacam (Meloxicam) for long-term oral treatment of chronic canine locomotor disorders. // 1 ST European congress CNVSPA — FECAVA. 1994, 661-663.
- Kothbauer O.: Uber die implantation von Goldpartikeln in Akupunkturpunkte zur therapeutischen Beeinflussung von schmerzhaften Prozessen im Huftgelenksbereich von Hunden – dargestellt an drei fallbeispielen. // Wien. Tierarztl. Mschr., 1997, 84, 47-52.
- Korthauer W., Torre J.: Behandlung deformierender Arthropatien beim diesthund mit einem neuen Glucosaminoglikanpraparat. // J. Kleintierpraxis, 1992, 37, 467-478.
- Kuijpers T.: Quadrisol 5. // Intervet International. Pre-clinical and clinical documentation. 1994, 119-122.
- Laszlo М., P. Schawalder, G. Scholtysik, C. Bernasconi, J. Schulze.: Untersuchungen an Hunden uber das Verhalten von Vitamin C bei Streb und Schmerz.// Kleintierpraxis, 1999, 44, 4, 241- 262.
- Lipowitz A.: Degenerative joint disease. In : Slatter D.: Textbook of small animal surgery.// Saunders comp. 1993, 1921-1927.
- Loeffler K., Mahler D.: Erkrankungen des Gliedmabenskeletts bei Hund und Katze. // Prakt. Tierarzt, 1983, 5, 401- 408.
- MacPhail C., Lappin M., Meyer D. et al.: Hepatocellular toxicosis associated with administration of carprofen in 21 dogs. // JAVMA. 1998, 12, 1895-1901.
- Mankin H., Radin E.: Chapter 8. Arthritis and Allied conditions. // 13 Edition, Edited by Williams & Wilkins, Baltimore 1997.
- Masferrer J., Zweiferi B., Seibert S.: Selective regulation of cellular cyclo-oxygenase by dexamethasone end endotoxin in mice. // J. Of Clinical Investigation. 1990. 86, 1375-1379.
- Mathews K.: Special report on nonsteroidal anti-inflammatory analgesics for pain management in cats and dogs. // Canadian veterinary jornal. 1996, 37, 539-545.
- McNamara P., Johnston S., Todhunter R.: Slow-actiog, disease-modifying osteoarthritis agents. // J. Veterinary clinics of North America: Small animal practice. 1997. 4, 863-891.
- Neimand H.: ManuellemFruhdiagnose und Therapie von HD und Koxarthrosen.// Tierarztl. Umschau, 1973, 283-287.
- Nethery A., Giles I., Jenkins K.: “The chondroprotective drugs arteparon and sodium pentosan polysulfate, increase collagenase activity and inhibit stromelysin activity in vitro”.// J. Biochemical Pharmacology. 1992, 44(8), 1549-1553.
- Niebauer G.,Wolf B., Bashey R., et al.: Antibodiees to canine collagen types I and II in dogs with spontaneous cranial cruciate ligament rupture and osteoarthritis.//J. Arthritis Rheumatol 1987, 30, 319-327.
- Pares V.: Laurabolin, the first class small animal,s anabolic agent. // Intervet International Clinical documentation 1995.
- Parrillo J., Fauci A.: Mechanisms of corticosteroid action on lymphocyte subpopulations. Differential effects of dexamethasone administration on subpopulations of effector cells mediating cellular cytotoxity in man. // Clin. Exper. Immunol. 1978, 31, 116.
- Partington M.: Gold implants for hip displasia. // Vet. Acup. Newsl. 1989, 15, 5-6.
- Paul S., Spenser A., Johnson V.: Slov-Acting , disease-modifying osteoarthritis agents. // J. Veterinary Сlinics of North America 1997, 4, 863-874.
- Pelletier J. et al.: Laboratory Investigation. // 1995, 72, 578-586.
- Pelletier J. et al.: Chapter 104 in “Arthritis and Allied Conditions”. // 1997, Williams &Wilkins, Baltimore.
- Peterkofsky B., Palka J., Wilson L., et al.: Elevated activity of low molecular weight insulin-like growth factor binding proteins in sers of vitamin C deficient and fasted guinea pigs.// J. Endocrinology 1999, 128, 1769-1779.
- Read R., Cullis – Hill D., Jones M.: Systemic use of penthosan polysulfate in treatment of ostheoarthritis. // J. of Smoll Animal Practis. 1996, 37, 108.
- Reimer M., Spencer A., Johnston M., et all.: The Gastroduodenal Effects of Buffered aspirin, carprofen, and Etodolac in Healthy Dogs. // Journal of Veterinary Internal Medicine. 1999, 13, 472-475.
- Reginster J., Derolsy R., Rouati L., et al.: “ Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomized, placebo-controlled clinical trial”. // The Lancet. 2001, 367, 248-251.
- Roessler B., et al.: Human Gene Therapy. // 1995, 4, 307-316.
- Rogachefsky R., Dean D., Howell D.: Treatment of canine osteoarthritis with insulin-like growth factor-1 and sodium pentosan polysulfate. // Osteoarthritis cartilage. 1993, 1, 105.
- Schneider – Haiss M.: Huftgelenksdysplasie bei Hunden. // 1990, Enke Verlag Stuttgart.
- Sevalla K., Todhunter R., Vernier-Singer M., et al.: Effect of Polysulfated Glucosaminoglycan on DNA Content and Proteoglycan Metabolism in normal and Osteoarthritic Canine Articular Cartilage Explants. // J. Veterinary Surgery. 2000, 5, 407-414.
- Tenenbaum J., Pritzker K.: The effects of intraarticular cortisteroids on articular cartilage. // Semin. Artritis Rheum. 1981, 11, 140.
- Ungemach F.: Pharmakologishe Beeinflussung von Entzundungen. In: Grundlagen der Pharmacotherapie bei Haus und Nutztieren. // Paul Parey, Verlag, Berlin und Hamburg 1991, 306-336.
- Vasseur P., Johnson A., Budsberg S., et al.: Randomized, controlled trial of the efficacy of carprofen, a nonsteroidal anti-inflammatory drugs, in the treatment of osteoarthritis in dogs. // JAVMA, 1995, 206, 807.
- Wallace M.S., Zawie D.A., Garvey M.S.: Gastric ulceration in the dog secondary to the use of nonsteroidal anti-inflammatory drugs.// J. Am. Anim. Hosp. Assoc. 1990, 26, 467-472.
- Zurier B.: Essential fatty acids and inflammation.// Ann. Rheumatic Dis. 1991, 50, 745–746.
С.А. Ягников
http://yagnikov.ru/directions/orthopedy/97-dysplasia